Erelijst
Populaire inhoud
Toont inhoud met de hoogste reputatie op 03/10/13 in alle zones
-
Voornaamste doel van dit experiment, is aan te tonen dat glucose een overmaat aan kaliumpermanganaat kan neutraliseren, naar aanleiding van een tip van @vheeswijk. De steriliserende werking van kaliumpermanganaat is afdoende getest en beschreven in de literatuur. Kaliumpermanganaat (KMn04) is een sterke oxidator en ontleedt gemakkelijk onder afgifte van zuurstof (O2) tot kaliumhydroxide (KOH) en mangaan(IV)oxide (MnO2). Hierbij worden bacterieen en virussen vernietigd en zal het ook een aantal chemische verontreinigingen oxideren. Busje met 250gr kaliumpermanganaat, vijzel en druivensuiker van 't Kruidvat. Je hoeft slecht een minieme hoeveelheid kaliumpermanganaat te gebruiken, voor een glas, zoals in het voorbeeld, is letterlijk een stofje genoeg. Meestal over doseer je en moet je het mengsel verdunnen. Zolang het een zeer lichte tint paars/roze behoudt, is er actief kaliumpermanganaat aanwezig en doodt het bacterieen. Voor de zekerheid, zou ik de oplossing een kwartiertje of langer laten staan en af en toe roeren. De kristallen kaliumpermanganaat lossen redelijk op, maar vaak blijft er onderin nog wat onopgeloste kristallen liggen. foto1, glas met oplossing van schoon kraanwater en kaliumpermanganaat: Nu kan dit meteen gedronken worden, zoals in survivalboeken wordt uitgelegd, net als bij waterzuiveringstabletten, is het niet bijzonder schadelijk bij tijdelijk of incidenteel gebruik. We kunnen de overdaad kaliumpermanganaat ook neutraliseren met glucose, in de volksmond druivensuiker genoemd en vervolgens filtreren. Dit is uiteraard beter voor de gezondheid, zeker op langere termijn. Mangaanoxide is niet bijzonder giftig in dergelijk kleine hoeveelheden, maar gezond is anders. Hiervoor heb ik een tabletje kruidvat druivensuiker/glucose fondant (naturel) gebruikt, die ik heb fijn gestampt in m'n vijzel. Dit toevoegen en dan geduld, de reactie duurt even. foto2, glas met kaliumpermanganaat en net de fijngestampte tablet toegevoegd, een troebele, licht roze oplossing: foto3, Uurtje later, na regelmatig roeren, glas met geneutraliseerde kaliumpermanganaat dmv glucose: Wellicht niet op de foto te zien, maar ipv van een licht roze oplossing, is dit een wat troebele licht gele/bruine oplossing, zoals verwacht. Als je deze oplossing lang laat staan, zal de mangaanoxide bezinken. Langzamerhand wordt het water bovenin het glas doorzichtiger en onderin bruiner. Ik gooi het gewoon door een koffiefilter, jammer genoeg heb ik geen witte koffiefilters, dus een stukje wit toilletpapier toegevoegd. foto4, na filtratie door koffiefilter, nog een licht gele kleur over: Het koffiefilter haalt niet alle mangaanoxide uit de oplossing, alleen wat is samengeklonterd en neergeslagen, in het geval van schoon kraanwater zijn er dus weinig vaste deeltjes, op een foto niet te zien in het filter. De smaak van het water is nu heel licht zoetig, met een lichte bijsmaak. Om te kijken of deze bijsmaak komt van de overgebleven mangaanoxide in oplossing, het onstane kleine beetje (overigens onschadelijke) kaliumhydroxide, danwel de magnesiumsteraat of glucose uit de tabletjes, heb ik een oplossing gemaakt van schoon kraanwater met druivensuiker. Mijn smaakpapillen nemen weer datzelfde bijsmaakje waar, dus het is simpelweg de magnesiumsteraat of de druivensuiker wat een raar smaakje heeft. Conclusie: Glucose neutraliseert het overschot aan kaliumpermanganaat. Filtratie van mangaanoxide gaat maar gedeeltelijk met een koffiefilter. Opmerking: Indien de kaliumpermanganaat reageert met bacterieen en algen, krijg je een bezinkels(oxide) wat niet in oplossing blijft en dus beter gefilterd kan worden dan mangaanoxide op zich. Laten bezinken is ook een goede optie. In een zuur milieu, neemt de oxiderende werking van kaliumpermanganaat af. Wat ging er fout, bij dit experimentje: Ten eerste een veel te sterke oplossing gemaakt, die was na vier tabletjes glucose nog niet geneutraliseerd. Ten tweede, een druppelstop is handig voor je koffiekan, maar lastig als je het los boven een glas gebruikt. Ten derde, als ik slootwater had gebruikt, was er meer bezinksel onstaan (dode bacterieen en algen), beter zichtbaar in het filter. Nu was het doel van het experiment niet om aan te tonen dat water gesteriliseerd kan worden met kaliumpermanganaat, zie begin van deze post. Tip: Maak een oplossing van oververzadigd kaliumpermangaat in een flesje met druppelpipet (te koop bij de apotheek voor een habbekrats), dan heb je niet de kans op kristalletjes die onopgelost op de bodem blijven liggen. Ander gebruik van kaliumpermanganaat: Een duidelijk roze oplossing, kan gebruikt worden om wonden mee te steriliseren. Nog sterkere oplossing is in het verleden gebruikt om in de sneeuw een noodsignaal te maken. Toegevoegd aan brandstof, bv suiker, versneld dit de verbranding aanmerkelijk. Suiker, kaliumpermanganaat en glycol ontbrandt spontaan. Het is me echter nog niet gelukt met koelvloeistof van auto's, danwel antivries ruitensproeiervloeistof, pure glycol heb ik jammer genoeg niet. Kaliumpermanganaat is te bestellen bij de chemische groothandel en is vrijgesteld van restricties. Een enkele apotheek heeft het ook of kan het bestellen, maar aangezien het aantal apotheken in NL dat nog zelf medicijnen maakt erg klein is geworden, is dat zoeken. (Dit komt door regelgeving, tegenwoordig moeten zelfs de simpelste zalfjes in een cleanroom gemaakt worden, dus zijn er nog maar weinig apotheken die daar de mogelijkheden voor hebben.)1 punt
-
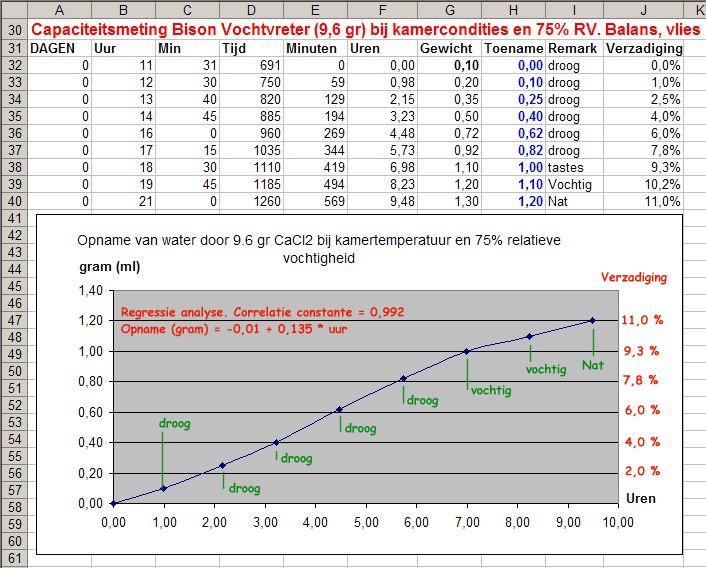
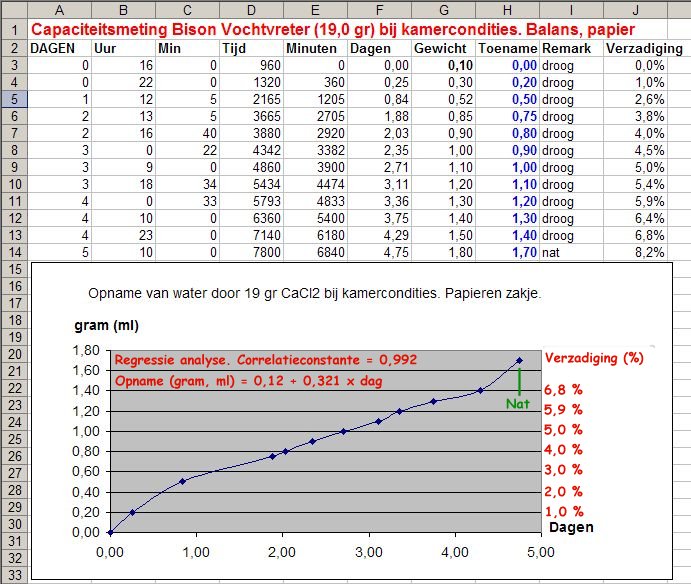
Introductie. Veel hand-droge voedingsmiddelen bevatten nog veel water maar dit water is heel goed 'gebonden' aan het voedsel. Dit vocht is zélfs voor bacterieën niet toegankelijk en draagt ook niet bij in de relatieve vochtigheid (RV) van de lucht boven het voedsel. In het algemeen geldt dat als de relatieve vochtigheid van de atmosfeer beneden de 15-20% ligt dat bacteriegroei niet meer mogelijk is. Dat geldt zowel voor de aerobe (zuurstof-minnende) als anaerobe (zuurstof-onafhankelijke) bacterieën. Bacterie-groei is dus zeker mogelijk op een te vochtig product in een atmosfeer die géén zuurstof meer bevat. Het belang van een goed droogmiddel wordt alom onderschat. Die van een zuurstof-adsorber wordt overschat. In de wereld van de droogmiddelen geldt de wet: "Wie het sterkst is wint". Bijvoorbeeld: Met droge rijst kun je keukenzout drooghouden, het vocht trekt dan in de rijst. Maar rijst kun je weer drogen met calciumchloride of silicagel omdat deze middelen weer sterker zijn dan rijst in drogend vermogen. In dit nieuwe draadje worden kwantitatieve (meet)gevevens verstrekt van voornamelijk "Bison Vochtvreter" (calcium chloride) en silicagel. Kwantitatieve gevevens over luchtvochtigheid. (aka. hoeveel droogmiddel moet ik gebruiken). Het begrip absolute vochtigheid geeft aan hoeveel water (gram) maximaal in de lucht kan zitten bij een bepaalde temperatuur. Hier bestaan tabellen voor maar het mooiste is wel een calculator op het internet. Zo kan 1 kubieke meter lucht bij 20 grad. C maximaal 17,3 gram water bevatten. De relatieve vochtigheid is uiteraard dan 100%. In een opslag tonnetje of emmer van 25 Liter inhoud betekent dat dan 17,3*25L/1000L = 0,44 gram water aanwezig is. Deze hoeveelheid water kan gemakkelijk worden verwijderd met één papier zakje die ca. 20 gram calciumchloride bevat. Sterker nog: De hoeveelheid lucht in dat tonnetje is veel minder dan 25 liter als deze met prep-voedsel is gevuld. Bovendien zal de relatieve vochtigheid hopelijk ook fors lager zijn dan 100% als u afvult. Eén zakje met ca. 15-20 gram Bison vochtvreter (calciumchloride) is dan ruim voldoende om bv. 25 liter hand-droge rijst droog te houden. Een andere vraag is: Kom ik dan ook beneden die 15% relatieve vochtigheid die bacterie-groei onmogelijk maakt? Hiervoor bestaan ook tabellen op het internet. Dan blijkt dat de hoeveelheden rest-water Samenvatting van de resultaten. Ik heb van calciumchloride in zakjes zowel de opname-snelheid van water als de opname-capaciteit gemeten. De meeste leden van dit forum zijn eerder geïnteresseerd in de ter zake doende resultaten dan hoe de experimenten feitelijk zijn uitgevoerd. De opname van water is gemeten door zakjes met droogmiddel te leggen op een balans en de gewichts-toename te meten als functie van de tijd. Experimenten zijn uitgevoerd bij 8 graden en bij 20 graden celcius en bij de relatieve vochtigheden bij kamercondities en bij 75% en 100% RV. Bij zéér hoge luchtvochtigheid (bv. 75% en 100%) wordt het papier van het zakje respectievelijk vochtig en nat. Dit vocht lost wat calciumchloride op wat je ook kunt proeven aan de buitenkant van het zakje. Bij de heersende relatieve luchtvochtigheid treedt dit effect niet op. De opnamesnelheid hangt af van de relatieve vochtigheid; bij een RV van 75% moet de opnamesnelheid worden uitgezet tegen uren en onder kamercondities eerder tegen dagen. De voor de opnamesnelheid moet men in de praktijk rekenen van maximaal 0,32 gram water per dag voor een zakje van 20 gram CaCl2. De capaciteit van calciumchloride ligt rond de 1,4 gr (=1,4 ml) water per zakje van 20 gram. In feite ligt deze véél hoger, maar ik heb tevens gekeken naar het vochtig worden van het papier van het droogzakje. Praktische aanwijzingen voor de prepper. Producten moeten al droog zijn als je ze afvult. U kunt er van uitgaan dat de meeste handelsproducten al droog genoeg zijn (anders waren ze in de schappen al niet houdbaar). Gebruik ongeveer 20 gram (twee eetlepels calciumchloride) in papieren zakjes, bv. kant-en-klare theezakjes en maak deze zakjes op droge dagen. Bewaar uw droogzakjes in bv. een ZIP-lock bag. U ziet aan de grafieken hieronder dat het droogmiddel direct aan de gang gaat. Als u ze aan de lucht laat liggen zijn ze, net als zuurstofadsorbers, na een paar dagen uitgewerkt en waardeloos! Vul prep-voer af op dagen waar de relatieve vochtigheid van de lucht relatief laag is. Bijvoorbeeld op koude winterdagen of s'zomers met oostenwind. Het droogmiddel moet zorgen dat de relatieve vochtigheid van de atmosfeer boven het product beneden de 15% komt. Een zakje van 20 gram is ruim voldoende om een ruimte van 25L kurkdroog te maken. Een afgevuld tonnetje bevat uiteraard beduidend minder dan 25 L lucht. De snelheid van drogen zal afhangen van de "dichtheid" van prepvoer. Het vocht moet immers naar het droogmiddel toe kunnen diffunderen. Dat kan dagen tot weken duren. Dit droogproces kan worden versneld door meerdere zakjes over de massa te verdelen. Je hebt dan een "overkill" aan drogend vermogen. Calciumchloride is niet giftig. Mocht wat droogmiddel door een calamiteit in het voedsel komen dan is voor de bereiding spoelen met water voldoende om de stof geheel te verwijderen. In een SHTF-situatie kan calcium chloride worden gebruikt als calcium-suppletie bij calcium-deficiëntie en osteoporose. Minieme sporen van calciumchloride kunnen al corrosief zijn voor ferro-metalen. Gebruik derhalve silicagel voor het droog bewaren van batterijen en electronica. Hieronder vindt u relevante meetgegevens @vheeswijk (chemicus)1 punt
-
https://www.youtube.com/watch?v=FXj7antqNn4 [MOD] Over de docu: ''For 30 years New Mexico-based Reynolds and his green disciples have devoted their time to advancing the art of "Earthship Biotecture" by building self-sufficient, off-the-grid communities where design and function converge in eco-harmony. However, these experimental structures that defy state standards create conflict between Reynolds and the authorities, who are backed by big business. '' Deze documentaire getiteld ''Garbage Warrior'' gaat over Reynolds welke zich bezig houdt met Earthships (alternatieve woonvormen) welke een duurzame manier van wonen vormen. Gelet op de wijze waarmee hij zich bezighoudt met een duurzaam bestaan vond ik het nodig deze link met jullie te delen. >>Dit kleine beetje tekst hierboven voegt al een hele berg informatie/waarde toe aan deze post. Graag het verzoek aan ALLEN om niet zomaar links/artikelen te droppen in het forum hier. Neem even de moeite om te vermelden WAT hetgeen is wat je deelt en WAAROM je dit deelt of wat precies de link met preppen is/kan zijn. Wij gaan voor kwaliteit hier allemaal neem ik aan ...1 punt
-
1 punt